El ayuno intermitente se ha puesto de moda por sus supuestos beneficios para la salud y el peso. Pero, como en todo, el exceso puede ser perjudicial, y en el caso del ayuno prolongado o mal planificado, tu salud sexual podría verse seriamente afectada.
Aquí te explico por qué, de forma clara y sencilla.

🔍 ¿Qué es el Ayuno Extremo o Prolongado?
No hablamos de saltarse una comida de vez en cuando, ni de un ayuno intermitente bien llevado (por ejemplo, 16 horas de ayuno y 8 de ingesta). Nos referimos a periodos de ayuno muy largos (más de 24 horas, o incluso días) o a una restricción calórica severa y constante.
⚖️ La Energía es Clave para tu Deseo y Función Sexual
Piensa en tu cuerpo como una empresa. Si la empresa no tiene suficientes recursos (energía, nutrientes), ¿qué es lo primero que recorta? Las áreas que no son vitales para la supervivencia inmediata. Y aunque el sexo es fundamental para la especie, la reproducción no es una prioridad cuando el cuerpo siente que está "en peligro" o en escasez de recursos.
Aquí es donde el ayuno extremo puede hacer daño:
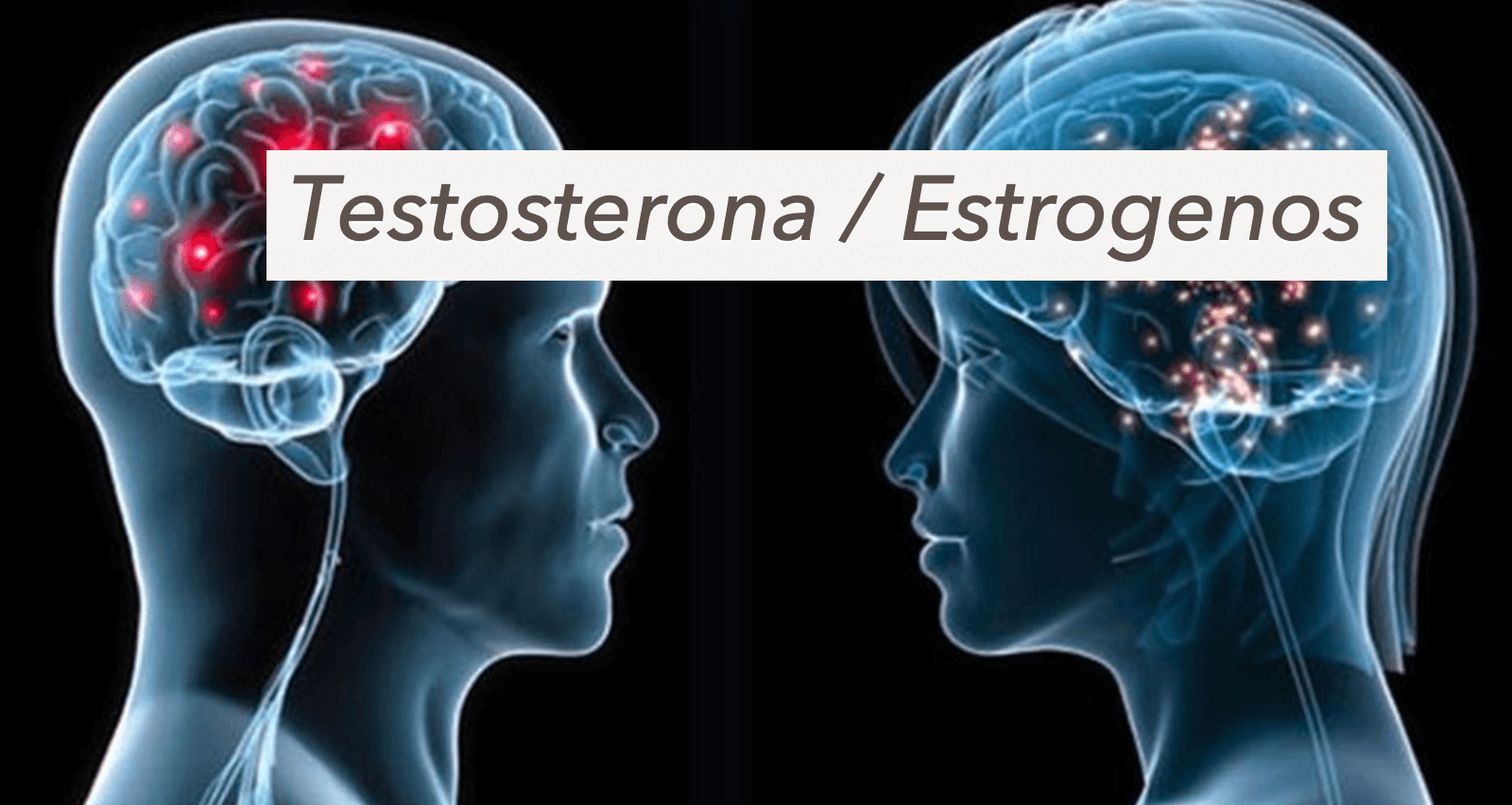
1. Desequilibrio Hormonal: El Gran Culpable
* Hormonas Sexuales (Testosterona y Estrógenos): Para producir testosterona en hombres y estrógenos en mujeres (cruciales para el deseo sexual y la función reproductiva), tu cuerpo necesita energía y nutrientes. El ayuno prolongado o la restricción desproporcionada de calorías pueden reducir drásticamente los niveles de estas hormonas. En mujeres, esto puede llevar a ciclos menstruales irregulares o incluso la ausencia de la regla (amenorrea), lo que indica un problema reproductivo. En hombres, la baja testosterona se traduce en pérdida de libido, fatiga y, en ocasiones, disfunción eréctil.
* Hormonas del Estrés (Cortisol): El ayuno, especialmente si es extremo o se realiza bajo mucho estrés, puede elevar los niveles de cortisol, la "hormona del estrés". El cortisol alto de forma crónica no solo te hace sentir ansioso o irritable, sino que también puede suprimir la producción de hormonas sexuales, creando un círculo vicioso.
* Kisspeptinas: Estas son unas hormonas cerebrales fundamentales que regulan el sistema reproductivo. El ayuno prolongado o una restricción calórica muy agresiva disminuyen las kisspeptinas, lo que desencadena una cascada de efectos negativos en la ovulación, el ciclo menstrual y la producción de esperma.
* Hormonas Tiroideas: Dietas muy bajas en calorías pueden reducir la función de la tiroides, afectando tu metabolismo general y, por ende, tu energía y deseo sexual.
2. Falta de Energía y Fatiga Crónica : Cuando tu cuerpo no recibe la energía necesaria de forma consistente, se siente agotado. La fatiga crónica es un efecto secundario común del ayuno extremo y, lógicamente, la falta de energía se traduce directamente en una disminución del deseo sexual (libido). Es difícil sentirte sexy o con ganas de intimidad cuando te sientes constantemente cansado o mareado.
3. Deficiencias de Nutrientes : El ayuno prolongado puede llevar a la falta de vitaminas y minerales esenciales. Micronutrientes como el zinc, el selenio y diversas vitaminas son vitales para la producción de esperma, la salud hormonal y la función sexual en general. Su déficit puede comprometer seriamente tu fertilidad y tu libido.
4. Impacto en la Fertilidad: Más allá del deseo, el ayuno extremo puede afectar directamente tu capacidad para concebir.
* En mujeres, puede alterar la ovulación y los ciclos menstruales, reduciendo las posibilidades de embarazo.
* En hombres, la deshidratación o la falta de nutrientes pueden afectar la calidad y cantidad del esperma.
5. Efectos Psicológicos Negativos : El ayuno puede generar irritabilidad, mal humor, obsesión con la comida y ansiedad. Estos estados de ánimo, lógicamente, no son propicios para una vida sexual plena y satisfactoria.
🎯 Notas para casa
Si bien el ayuno intermitente, bajo supervisión y de forma controlada, puede tener beneficios metabólicos, el ayuno extremo o prolongado representa un riesgo significativo para tu salud, y muy especialmente para tu salud hormonal y sexual.
Tu deseo sexual y tu capacidad reproductiva son indicadores sensibles de tu bienestar general. Si estás experimentando problemas de libido, disfunción eréctil o alteraciones menstruales y estás practicando ayunos severos, es fundamental que:
* Reconsideres tu enfoque nutricional.
* Consultes a un médico o un especialista en nutrición que pueda evaluar tu caso de forma individual.
No sacrifiques tu vida sexual ni tu fertilidad en nombre de una dieta. El equilibrio y la nutrición adecuada son siempre tus mejores aliados para una salud plena.
MADRID UROLOGIA
Consultas de 1 hora. Pruebas inmediatas. Cirugías en 3 días
Visítanos y comprueba los beneficios de una consulta 100 % privada
📍 Calle Corazón de María 23. Primero B. Madrid
📨 citas@madridurologia.com
📞910 32 73 74
📱656727747
1.Effect of Intermittent Fasting on Reproductive Hormone Levels in Females and Males: A Review of Human Trials. Cienfuegos S, Corapi S, Gabel K, et al. Nutrients. 2022;14(11):2343. doi:10.3390/nu14112343.
2.5. Facilitating Positive Health Behaviors and Well-Being to Improve Health Outcomes: Standards of Care in Diabetes-2025.Diabetes Care. 2025;48(Supplement_1):S86-S127. doi:10.2337/dc25-S005.
3. Traditional and Medical Applications of Fasting. Visioli F, Mucignat-Caretta C, Anile F, Panaite SA. Nutrients. 2022;14(3):433. doi:10.3390/nu14030433.